7月8日,成都纽瑞特医疗科技股份有限公司自主创新研发的钇[90Y]炭微球注射液获国家药品监督管理局批准临床试验(受理号:CXHL2200233,通知书编号:2022LP01053)。该品种注册分类为:化学1类,是继钇[90Y]玻璃微球(持有人:美国波士顿科学公司)、钇[90Y]树脂微球(持有人:澳大利亚Sirtex Medical公司)后全球第三代经药监部门许可进入临床或临床研究的钇[90Y]微球。
产品介绍
钇[90Y]炭微球注射液产品由纽瑞特医疗的科研团队历时四年自主研发制成。截至目前,该产品已获得发明专利4项,申请发明专利2项、PCT专利2项,具有完整的自主知识产权,公司是全球唯一成功实现核心原料三氯化钇[90Y]溶液、炭微球自主研制与生产的医药企业。
钇[90Y]炭微球注射液是选择性内照射治疗(SIRT)用放射性微球,是以炭微球为载体负载高活度的放射性钇[90Y]而得,通过DSA介入手术经肝动脉灌注至肿瘤供血动脉。钇[90Y]炭微球随血流分布并阻滞于肿瘤组织微小动脉和毛细血管中,钇[90Y]发射纯β射线,平均能量为0.9367MeV,最大组织穿透距离为11mm,平均组织穿透距离为2.5mm,最终通过选择性内照射治疗杀死肿瘤细胞达到治疗目的。钇[90Y]炭微球注射液产品具备突出优势:
一、本品可实现全天候生产供应;
二、本品比活度高、货架期长(8天)、返流风险小;
三、本品比重适宜,易于灌注,且核心指标均达到或优于国际同类产品水平。
在产品研发过程中,考虑到患者的剂量需求差异,为达到最佳治疗效果,纽瑞特医疗攻克重重生产技术难关,研制出多种规格的钇[90Y]炭微球注射液。医生可为患者“量身定制”放射性剂量,实现个体化的精准治疗。
此外,为最大程度降低医护人员在给药过程中受到的放射性辐照剂量和避免放射性物质泄露,纽瑞特医疗精心设计了配套的给药管路系统,顺利搭建起远程、高效、安全的给药路径。
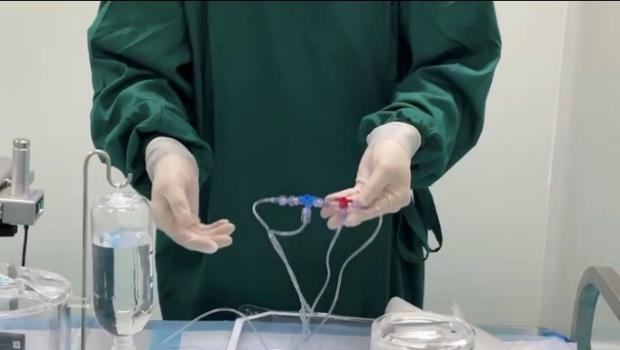

市场分析
据国家癌症中心数据显示,2020年中国癌症新发病例457万,死亡病例300万,其中肝癌新发病例41万(8.97%),排名第五;死亡病例39万(13%),排名第二。因肝癌具有发病隐匿且进展快、术后复发转移发生率高的特点,在中国多达70%—80%的患者在首次治疗时已不具备手术切除条件,国内肝癌患者的五年总生存率仅14.1%。现阶段,国内肝癌患者巨大而紧迫的临床治疗需求尚未被很好地满足。
为此,纽瑞特医疗钇[90Y]炭微球注射液产品的第一个适应症为:转移性肝癌。计划在2022年完成第一例临床试验入组,争取早日完成临床试验,实现中国肝癌患者用药的可及性,治病救人造福社会。
纽瑞特医疗将以本次获准临床试验为契机,积极开展钇[90Y]炭微球治疗其它实体肿瘤的研究,以满足更多的临床需求,并将持续创新放射性药物和医用同位素产品,为放射性药物事业发展创新不辍、竭智尽力。
